Resuminho sobre crase
NÃO SE USA CRASE:
-
antes de palavras masculinas.
ex: forno a gás (gás é masculino).
- Medidas de distância
ex: daqui a 100 metros.
- antes de verbos
ex: "a partir", "a combinar", etc.
- antes de artigos indefinidos (uns, umas, um, uma) e pronomes (esses, esse,
essas, essa)
ex: ela foi a essa loja.
- locuções formadas por palavras repetidas.
ex: lado a lado, face a face.
- quando, mesmo sendo uma palavra feminina, não houver concordância.
ex: ele discursou a mulheres. (se usa crase se for "ele discursou às
mulheres")
- quando se volta "DE" algum lugar.
ex: vou a Recife (volto DE Recife)
ex2: vou à Itália (volto DA Itália)
SE USA CRASE:
- antes de palavras femininas, em geral.
- Sempre que se referir "à moda de alguma coisa": Vou fazer algo à
Zidane. (à moda de Zidane)
- Horas levam sempre crase (às 10 horas)
- antes de pronomes demonstrativos (aqueles, aquelas)
ex: vou àquele lugar.
quinta-feira, 26 de abril de 2012
quinta-feira, 19 de abril de 2012
Física
Eletrostática
Elétron: carga negativa
Próton: carga positiva
Nêutron: nenhuma carga
Carga do elétron: -1,6 . 10-19 C
Carga do próton: +1,6 . 10-19 C
1mC (milicoulomb) = 10-3C
1µC (microcoulomb) = 10-6C
1nC (nanocoulomb) = 10-9C
1pC (picocoulomb) = 10-12C
Lei de Du Fay: Cargas elétricas de mesmo sinal se repelem, e as de sinais contrários se atraem.
Apenas as cargas negativas se deslocam.
Condutores: os portadores de carga elétrica tem grande liberdade de movimento; exemplo: metais, grafite, gases ionizados, soluções eletrolíticas, etc.
Elétron: carga negativa
Próton: carga positiva
Nêutron: nenhuma carga
Carga do elétron: -1,6 . 10-19 C
Carga do próton: +1,6 . 10-19 C
1mC (milicoulomb) = 10-3C
1µC (microcoulomb) = 10-6C
1nC (nanocoulomb) = 10-9C
1pC (picocoulomb) = 10-12C
Lei de Du Fay: Cargas elétricas de mesmo sinal se repelem, e as de sinais contrários se atraem.
Apenas as cargas negativas se deslocam.
Condutores: os portadores de carga elétrica tem grande liberdade de movimento; exemplo: metais, grafite, gases ionizados, soluções eletrolíticas, etc.
Isolantes: os portadores de carga não encontram facilidade de movimento, tais como ar atmosféricos, o vidro, a borracha, o plástico, etc.
Processos de eletrização:
Atrito: dois objetos neutros se atritam e ficam carregados com sinais contrários.
Exemplo: Blusas de lã eletrizam-se por causa do atrito com o corpo do usuário.
Contato: um objeto eletrizado fica em contato com outro neutro, os dois ficam com a mesma carga.
Indução: os corpos ficam carregados com cargas de sinal contrário.
Marcadores:
atrito,
carga,
condutores,
contato,
elétrica,
elétron,
Eletrostática,
Física,
indução,
isolantes,
lei de du fay,
microcoulomb,
milicoulomb,
nanocoulomb,
picocoulomb
História
Guerra do Peloponeso: guerra entre Esparta e Atenas, Esparta
ganhou.
Causas da guerra:
- Os espartanos viam como ameaça o desenvolvimento econômico e aumento da influência política de Atenas na região da península do Peloponeso;
- Relações tensas entre as duas cidades-estados e disputa pela hegemonia política e econômica na região;
Consequências
Os espartanos deram suporte a um golpe oligárquico em Atenas, derrubando o sistema democrático e implantando um sistema de governo autoritário conhecido como Tirania dos Trinta.
O fim da guerra derrubou o poder de Atenas na península e resultou na hegemonia política e economia de Esparta na região, com seu sistema voltado para o fortalecimento militar.
- Os espartanos viam como ameaça o desenvolvimento econômico e aumento da influência política de Atenas na região da península do Peloponeso;
- Relações tensas entre as duas cidades-estados e disputa pela hegemonia política e econômica na região;
Consequências
Os espartanos deram suporte a um golpe oligárquico em Atenas, derrubando o sistema democrático e implantando um sistema de governo autoritário conhecido como Tirania dos Trinta.
O fim da guerra derrubou o poder de Atenas na península e resultou na hegemonia política e economia de Esparta na região, com seu sistema voltado para o fortalecimento militar.
quarta-feira, 18 de abril de 2012
Filosofia
Aristóteles
Ética: alcançar a felicidade.
A virtude é o meio-termo (estado considerado ideal pra ele)
e o vício se dá ou na falta ou no excesso. Por exemplo: coragem é uma virtude e
seus contrários são a temeridade (excesso de coragem) e a covardia (ausência de
coragem).
Se a ética está preocupada com a felicidade individual
do homem,
a política se preocupa com a felicidade coletiva da polis.
Sócrates
Maiêutica de Sócrates: significa parto das idéias. Ele
questionava as pessoas e as levava através das perguntas a ter novas idéias
sobre o assunto abordado.
Política: acreditava que só os filósofos estavam preparados
para governar.
Maquiavel é o pai da política moderna e Galileu é o pai da
ciência moderna.
Antes a política significava só viver bem na polis, mas
Maquiavel revolucionou esse conceito e passou a ser o mesmo que entendemos de
política até hoje.
Hobbes
livro: o leviatã – fala sobre a natureza humana e
sobre o contrato social. Defende o
contrato social e um governo soberano absoluto. O homem é mal por natureza e está em constante
guerra, por isso precisa de um contrato social para viver em sociedade. O homem é o lobo do homem.
Descartes
pai do racionalismo. A duvida é o primeiro passo
para se chegar ao conhecimento. – penso, logo existo.
terça-feira, 17 de abril de 2012
Astronomia
Estrelas
As estrelas são esferas enormes - entidades gasosas com uma variedade de massas, tamanhos e temperaturas, cuja fonte de energia é a transformação de elementos através de reações nucleares, isto é, da fusão nuclear de hidrogênio em hélio e posteriormente em elementos mais pesados. Quase todos os elementos que ocorrem na natureza mais pesados que o hélio foram criados por estrelas. As estrelas normais, não colapsadas, têm temperaturas efetivas entre 2500K e 40 000K.
Estima-se que existam 100 bilhões de estrelas no Universo. O Sol é o astro mais próximo da Terra, o único visível durante o dia e parece um grande e redondo disco no céu. As outras estrelas estão tão longe de nós que só cintilam no céu à noite. Esse brilho é causado pela distância que estão de nós e pelo efeito da atmosfera no nosso planeta.
Um diagrama da temperatura de muitas estrelas contra suas luminosidades, conhecido como Diagrama de Hertzsprung-Russell(Diagrama H-R), permite determinar a idade e o estado evolucionário de uma estrela.
Quase tudo numa estrela é determinado pela sua massa inicial, inclusive características essenciais como luminosidade e tamanho, bem como a sua evolução, tempo de vida e destino final. Quando as estrelas se formam na atual Via Láctea, elas se compõem de cerca de 71% de hidrogênio e 27% de hélio.
O movimento de uma estrela em relação ao Sol pode fornecer informações úteis sobre a origem e a idade da estrela, assim como sobre a estrutura e evolução da galáxia que a cerca. Os componentes do movimento de uma estrela são a velocidade radial, aproximando-se ou afastando-se do Sol, e o movimento angular transversal, que é chamado o seu movimento próprio.
O Sol é formado por 70% de hidrogênio, 28% de hélio e 2% de metais. A fusão nuclear é a responsável pela produção de energia que o faz brilhar com tanta intensidade.
Sirius é a maior e a mais brilhante estrela no céu.
Idade
A maioria das estrelas tem entre 1 bilhão e 10 bilhões de anos. Algumas estrelas podem até estar próximas de 13,7 bilhões de anos. Quanto maior a massa de uma estrela, menor seu tempo de vida, principalmente porque as estrelas grandes têm maior pressão nos seus núcleos, fazendo com que elas queimem hidrogênio mais rapidamente. As estrelas maiores duram em média cerca de um milhão de anos, enquanto estrelas de massa mínima (anãs vermelhas) queimam seu combustível muito lentamente e duram dezenas a centenas de bilhões de anos.
quinta-feira, 12 de abril de 2012
Física – 2º ano
Termologia
Ramo da física que estuda os fenômenos físicos relacionados ao calor.
A energia térmica é a energia cinética (movimento) associada à agitação térmica das moléculas. As moléculas de água fria possuem menor agitação térmica que as de água morna, e estas, menor do que as de água quente.
Temperatura: grandeza física que mede o nível de agitação térmica das partículas.
Calor é energia térmica em trânsito.
Quando se diz que o corpo A tem temperatura superior à do corpo B, significa que o nível de agitação térmica das partículas do A é maior que o das partículas do B.
Escalas termométricas
Para estabelecermos uma escala termométrica escolhemos dois pontos: a temperatura de fusão do gelo e a temperatura do vapor d'água em ebulição.
Escala Celsius 0ºC = ponto de fusão do gelo e 100ºC = vapor d'água em ebulição.
Escala Fahrenheit 32ºF = fusão do gelo e 212ºF= vapor d'água em ebulição.
Escala Kelvin (escala absoluta) 273K = fusão do gelo e 373K = vapor d'água em ebulição. (Na escala Kelvin não tem o símbolo de graus!)
Zero absoluto = -273ºC
Equação de conversão
Celsius para Kelvin
θC = T(K) – 273 ou T(K) = θC + 273
http://www.fisicafacil.pro.br/calculoescala02.htm
Dilatação Térmica
Quando ocorre elevação na temperatura de um corpo, suas dimensões aumentam. Acontece em todas as direções e sentidos.
Exemplos: Entre os trilhos de uma estrada de ferro, deixam-se pequenos vãos, para ter espaço quando a dilatação acontecer.
Os fios condutores de eletricidade dos postes apresentam pequena folga (acontece contração térmica).
Os vidros com tampas de metal, se forem colocados na água quente se abrem facilmente pois a tampa de metal se dilata mais que o vidro.
Dilatação térmica linear
Para calcularmos a variação de comprimento do corpo que sofreu a dilatação linear utilizamos a seguinte equação:
∆L = L0 . α . ∆T
Onde:
∆L: variação de comprimento do corpo que sofreu a dilatação linear.
L0 : comprimento inicial do corpo.
α: coeficiente de dilatação térmica do material que constitui o corpo.
∆T: variação de temperatura sofrida pelo corpo.
∆T: T- T0
∆L: L – L0
-
Exercício
Um trilho de aço tem 100m de comprimento a 10°C. Qual o acréscimo de comprimento desse trilho quando a sua temperatura chega a 30°C?
(dado: coeficiente de dilatação linear do aço: αaço=1,1 . 10-5 °C-1)
Resolução:
L0 = 100m
∆T = 30 °C – 10 °C = 20 °C
αaço=1,1 . 10-5 °C-1
Aplicando a equação ∆L = L0 . α . ∆T , podemos encontrar a variação de comprimento do trilho:
∆L = L0 . α . ∆T
∆L = 100. 1,1 . 10-5 . 20
∆L = 0,022 m (acréscimo de comprimento do trilho)
O primeiro termômetro foi construído por Galileu Galilei.
terça-feira, 3 de abril de 2012
Química
Óxidos
São compostos binários nos quais um dos elementos químicos é
o O2
Ex: CO (monóxido de carbono)
CO2 (dióxido de carbono)
CaO (óxido de cálcio)
Classificação:
a) Óxidos ácidos: reagem com água originando ácidos. Ex: SO3 + H2O -> H2SO4
b) Óxidos básicos: reagem com água originando bases. Ex: CaO + H2O -> Ca(OH)2
Quimica
Bases ou hidróxidos
*Em solução aquosa, dissociam-se, fornecendo ânions
hidróxido (OH -)
*Possuem sabor adstringente (sensação de aspereza) como a
banana e caju verdes.
*Neutralizam os ácidos, formando os sais.
Nomenclatura
Acrescenta-se ás palavras: hidróxido de, ao nome do cátion que originou a base.
Ex: Hidróxido de sódio (NaOH)
Sais
É o grupo de substâncias iônicas que possuem um cátion diferente de H+ e um
ânion diferente de OH- .
*Tem sabor salgado.
* Conduzem bem a eletricidade, quando em solução.
* São obtidos da reação de ácidos e bases. Essa reação denomina-se reação de neutralização. Ex: o HCl reage com o hidróxido de alumínio, produzindo cloreto alumínio e água.
3HCl + Al
(OH)3 -> AlCl3 + H2O
(ácido) (base) (sal) (água)
Os sais são classificados em dois tipos:
1. Sais oxigenados: Contém O2 na fórmula. Ex: K2SO4, CaCO3.
2. Sais não-oxigenados: não contém O2 na fórmula. Ex: NaCl, FeS.
Nome dos sais
Coloca-se o nome do ânion seguido do nome do cátion.
Ex: NaNO2 : nitrato de sódio
Podemos nomear os sais a partir dos ácidos que lhes deram origem. No caso dos sais oxigenados, o nome deriva dos oxiácidos que lhes deram origem, fazendo as seguintes substituições:
Ex: O sal NaNO2 se origina do ácido
HNO2 -> ácido nitroso
NaNO2 -> nitrito de sódio
O sal KClO se origina do ácido
HClO -> ácido hipocloroso
KClO -> hipoclorito de potássio.
Quanto aos sais não-oxigenados, o nome dos hidrácidos que lhes deram origem, fazendo a seguinte substituição:
Ex: O sal NaCl se origina do ácido
HCl -> ácido clorídrico
NaCl -> Cloreto de sódio
*Ácidos, bases e sais, quando em meio aquoso, conduzem bem eletricidade, porque formam íons. Por isso tais substâncias são chamadas eletrólitos.
Química
Ácidos
* Em solução aquosa, liberam cátions hidrogênio [H+]
* Possuem sabor azedo.
* Reagem com os carbonatos e bicarbonatos, produzindo efervescência, por causa da liberação do CO2.
Classificação
a) Hidrácidos: não possuem O2 na molécula. Ex: HBr, HCl...
b) Oxiácidos: Possuem O2 na molécula.
Nomenclatura
a) Os hidrácidos levam a terminação ídrico
Ex: HCl -> ácido clorídrico
HI -> ácido iodídrico
b) Os oxiácidos levam a terminação ico e oso.
* oso: quando as moléculas desses mesmos elementos possuem menor nº de oxigênio.
Ex: H2SO4 : Ácido sulfúrico
H2SO3: Ácido sulfuroso
________________________________________________________
1. O mármore é constituído de carbonato de cálcio. Deixando-se cair algumas gotas de ácido clorídrico sobre o mármore, o que se observa? Por quê?
O mármore é constituído de carbonato que reage com o ácido clorídrico e da efervescência por causa da liberação do CO2
2.Qual dessas substâncias a seguir apresenta sabor azedo quando em solução aquosa? Na2S , NaCl, CaO, HCl, NaOH.
HCl
* Em solução aquosa, liberam cátions hidrogênio [H+]
* Possuem sabor azedo.
* Reagem com os carbonatos e bicarbonatos, produzindo efervescência, por causa da liberação do CO2.
Classificação
a) Hidrácidos: não possuem O2 na molécula. Ex: HBr, HCl...
b) Oxiácidos: Possuem O2 na molécula.
Nomenclatura
a) Os hidrácidos levam a terminação ídrico
Ex: HCl -> ácido clorídrico
HI -> ácido iodídrico
b) Os oxiácidos levam a terminação ico e oso.
* oso: quando as moléculas desses mesmos elementos possuem menor nº de oxigênio.
Ex: H2SO4 : Ácido sulfúrico
H2SO3: Ácido sulfuroso
________________________________________________________
1. O mármore é constituído de carbonato de cálcio. Deixando-se cair algumas gotas de ácido clorídrico sobre o mármore, o que se observa? Por quê?
O mármore é constituído de carbonato que reage com o ácido clorídrico e da efervescência por causa da liberação do CO2
2.Qual dessas substâncias a seguir apresenta sabor azedo quando em solução aquosa? Na2S , NaCl, CaO, HCl, NaOH.
HCl
Química
Tipos de ligações entre os átomos
Iônica
Transfere elétrons, formando íons. Quem tem 1, 2 ou 3 elétrons na última camada doa e fica positivo, e quem tem 5, 6 ou 7, recebe e fica negativo. Ex: Na+CL-
Normalmente ocorre entre metais alcalinos (Li, Na, K) e halogênios (F, Cl).
Leva a formação de sais que se forem dissolvidos em solução aquosa, conduzem eletricidade.
Covalente
Compartilha elétrons dos átomos que se ligam.
Iônica
Transfere elétrons, formando íons. Quem tem 1, 2 ou 3 elétrons na última camada doa e fica positivo, e quem tem 5, 6 ou 7, recebe e fica negativo. Ex: Na+CL-
Normalmente ocorre entre metais alcalinos (Li, Na, K) e halogênios (F, Cl).
Leva a formação de sais que se forem dissolvidos em solução aquosa, conduzem eletricidade.
Covalente
Compartilha elétrons dos átomos que se ligam.
Ligação covalente dativa
Ocorre da mesma forma
que a covalente simples, a única coisa que muda é a procedência do par de
elétrons compartilhado, que vem apenas de um dos átomos. Em outras palavras, na
ligação covalente dativa um átomo com a camada de valência já completa
compartilha elétrons com outro átomo de última camada ainda incompleta. Ela é
representada por uma seta que parte do átomo que doa seus elétrons para
compartilhar e vai até o átomo que recebe.
Quimica
Partes por milhão (ppm)
O número de PPM indica
quantas unidades de um componente há em 1.000.000 ou 106 unidades da
mistura.
Calcula-se com a fórmula:
1 ppm = 1 parte de soluto___
106 partes de solução
106 partes de solução
Se a solução for sólida ou líquida, a concentração em ppm é
dada em massa; Já se for no estado gasoso, ela será dada em volume.
Fração Molar (não tem unidade).
A fração molar de uma solução pode ser expressa
de duas maneiras:
- Fração molar do soluto.
- Fração molar do solvente.
- Fração molar do solvente.
A fração molar do soluto (F1) é
a relação entre o número de moles do soluto (n1) e o número de moles
da solução (n1+ n2).
A fração molar do solvente (F2)
é a relação entre o número de moles do solvente (n2) e o número de
moles da solução (n1+ n2).
Sendo: F1 = fração molar do soluto e F2 = fração molar do solvente
n1 = número de moles do soluto.
n2 = número de moles do solvente.
n = número de moles da solução ( n1 + n2 ).
A soma da fração molar do soluto (n1) e da fração
molar do solvente (n2) é sempre igual a um.
F1 + F2
= 1
Molalidade
A molalidade indica o número de moles do soluto em 1kg de solvente.
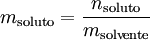
Nsoluto = número de moles do soluto;
Msolvente= massa do solvente em kg.
Unidades: moles/kg ou molal.
segunda-feira, 2 de abril de 2012
Quimica
Concentração das soluções
Componentes de uma solução
Os componentes de uma solução são chamados soluto e solvente:
* Soluto é a substância dissolvida no solvente. Quase sempre está em menor quantidade na solução.
*Solvente é a substância que dissolve o soluto.
O título de uma solução indica a massa de soluto contida em 1g de solução.
É usado a fórmula:
t = título da solução;
m1= massa de soluto;
m ou (m1+m2) = massa da solução;
As massas do soluto e da solução devem estar na mesma unidade. O título em massa não tem unidade, pois é uma divisão de dois valores de massa (a massa do soluto pela massa da solução), e as unidades se cancelam. O valor nunca pode ser maior do que 1.
Porcentagem em massa do soluto
Se multiplicarmos o título por 100, vamos ter a porcentagem
em massa do soluto.
Densidade da solução
Relaciona a massa e o volume da solução:
d = M/V
As unidades quase sempre usadas são g/mL ou g/cm³ .
Não confunda densidade com concentração comum, pois as duas
relacionam massa com volume. Na concentração comum se relaciona a massa de
soluto com o volume da solução e, na densidade, a massa de solução com o volume
da solução.
Química
Classificação dos elementos químicos
Metais
a. na temperatura ambiente são sólidos (exceto o mercúrio)
b. possuem brilho
c. conduzem bem o calor e a eletricidade
d. tendem a perder elétrons e ficar eletricamente positivos.
Ametais (ou não-metais)
Possuem características opostas às dos metais (exceto o enxofre e o fósforo, que são sólidos)
Gases Nobres
Não se combinam entre si nem com outros elementos químicos. São: Hélio (He), Neônio (Ne), Argônio (Ar), Criptônio (Kr), Xenônio (Xe) e Radônio (Rn).
Hidrogênio
Elemento químico com características diferentes: é o gás mais leve que se conhece; é inodoro, incolor e altamente combustível.
Isótopos
Átomos que têm o mesmo nº atômico, mas diferente nº de massa. Ex: 8O16, 8O17, 8O17
Isóbaros
Átomos que possuem diferentes nº atômicos e mesmo nº de massa. Ex: 19K40 e 20Ca40
Isótonos
Átomos que possuem nº atômicos diferentes e nº de massa iguais. Ex: 19Ca39 e 17Cl37
Para achar o número de nêutrons usa essa fórmula: A - Z = N , aonde A é a massa atômica e Z é o numero atômico.
Ca: 39 - 19 = 20 ; Cl: 37 - 17 = 20.
Ions
Quando os átomos perdem ou recebem elétrons.
Famílias
1a. metais alcalinos
2a. metais alcalinos terrosos
3a. boro
4a. carbono
5a. nitrogênio
6a. calcogênios
7a. halogênios
0. gases nobres
Metais
a. na temperatura ambiente são sólidos (exceto o mercúrio)
b. possuem brilho
c. conduzem bem o calor e a eletricidade
d. tendem a perder elétrons e ficar eletricamente positivos.
Ametais (ou não-metais)
Possuem características opostas às dos metais (exceto o enxofre e o fósforo, que são sólidos)
Gases Nobres
Não se combinam entre si nem com outros elementos químicos. São: Hélio (He), Neônio (Ne), Argônio (Ar), Criptônio (Kr), Xenônio (Xe) e Radônio (Rn).
Hidrogênio
Elemento químico com características diferentes: é o gás mais leve que se conhece; é inodoro, incolor e altamente combustível.
Isótopos
Átomos que têm o mesmo nº atômico, mas diferente nº de massa. Ex: 8O16, 8O17, 8O17
Isóbaros
Átomos que possuem diferentes nº atômicos e mesmo nº de massa. Ex: 19K40 e 20Ca40
Isótonos
Átomos que possuem nº atômicos diferentes e nº de massa iguais. Ex: 19Ca39 e 17Cl37
Para achar o número de nêutrons usa essa fórmula: A - Z = N , aonde A é a massa atômica e Z é o numero atômico.
Ca: 39 - 19 = 20 ; Cl: 37 - 17 = 20.
Ions
Quando os átomos perdem ou recebem elétrons.
Famílias
1a. metais alcalinos
2a. metais alcalinos terrosos
3a. boro
4a. carbono
5a. nitrogênio
6a. calcogênios
7a. halogênios
0. gases nobres
Química
Reações Químicas
Tipos:
*síntese: duas substâncias simples combinam-se parar formar uma nova composta.
A + B -> AB
*análise ou reação de decomposição: uma substância composta se desdobra em duas simples.
AB -> A + B
*simples troca: uma substância simples reage com uma composta, ocupando o lugar de um dos componentes da substância composta.
A + BC -> AC + B
*dupla troca: duas substâncias compostas reagem, trocando uma parte, formando duas novas substancias.
AB + CD -> AC + BD
Tipos:
*síntese: duas substâncias simples combinam-se parar formar uma nova composta.
A + B -> AB
*análise ou reação de decomposição: uma substância composta se desdobra em duas simples.
AB -> A + B
*simples troca: uma substância simples reage com uma composta, ocupando o lugar de um dos componentes da substância composta.
A + BC -> AC + B
*dupla troca: duas substâncias compostas reagem, trocando uma parte, formando duas novas substancias.
AB + CD -> AC + BD
Assinar:
Postagens (Atom)








